안녕하세요?
어떤 사람들은 유전자 조작기술이 간단하게 되는 것으로 생각하기도 하시겠지만, 실상은 대학원의 박사과정에 들어간 학생이 끙끙대며 설계를 제대로 해도 될까 말까 합니다. 물론 처음부터 모든 DNA서열을 조립하는 것은 아직은 먼나라 이야기 이기도 하기에, 요 근래에 들어서 나온 '크리스퍼/캐스나인-crispr/CAS9'이 왜 대단한 것인지 생각하면, 아직도 유전자 조작은 어려운 상황 이기는 합니다.
링크:유전자를 절단하는 효과적인 가위-크리스퍼/캐스나인-cripsr/CAS9에 대한 이야기
그러나 결국 crispr/CAS9도 유전자를 자르는 가위라는 점에서, 어느정도 문제를 내포하고 있기는 있습니다. 위 링크를 타고 들어가서 한번 내용을 읽어 보시면, 만약 유전자 A가 너무 발현이 되어서 문제가 된 유전병 A'를 치료하기 위해서는 유전자 A의 발현을 DNA서열 한가운데에 구멍을 내어서 발현을 막는 방법을 지금까지 써 왔습니다.
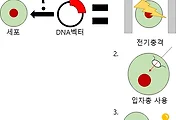
위 그림의 묘사에서 처럼, 제 아무리 뛰어난 크리스퍼/캐스나인도 유전자를 OFF시키지는 못하고, 그저 망가뜨려서 원래 하는 기능을 못하다로고 방해만 하는 것이 고작 입니다. 그러나 이번 포스팅에서 소개 하고자 하는 '에피게놈 편집'의 경우는 비슷 화면서도 다른 것이 있는데, 기존에는 유전자를 off시킨다-유전자의 발현을 막는 방법이 'knock out'인데, 이건 정확히 말하면 유전자의 발현을 스위치 꺼듯 off시킨다고 하기에는 무리가 있습니다.
지금까지의 knock out 과정은 위 그림의 묘사와 같이, 원래 정상적인 과정은 좌측의 과정으로 DNA가 설계도 이고, 유전자가 발현되는 과정은 마치 설계도를 가지고서 공장에서 제품을 만들듯이, 세포 안에서 라이보좀(ribosome)이 단백질을 만들게 됩니다. 이에 대한 더 자세한 내용이 궁금하시다면, 아래의 링크를 타고 들어가서 한번 읽어 주시기 바랍니다.
링크:단백질의 PTM(Post Translational Modification)
그럼 지금까지의 Knock out(넉 아웃) 은 위 그림의 오른편에 있는 과정의 묘사처럼 설계도의 일부를 담뱃불로 지져서 중요한 정보를 파손시켜서 손상된 설계도로 만들고, 이를 공장으로 가지고 가서 이 손상된 설계도 대로 만들어서 공장에서는 불량품이 마구 나오게 되는 것 입니다. 즉, 유전자의 발현을 막는다는 게, 세포의 공장에 해당하는 라이보좀(ribosome)에서 불량품 만 만들어서 기능을 못하게 만든 것이 전부 입니다.
그럼 여기서 에피게놈 편짐은 도대체 무엇이 다르냐는 의문이 드실 건데, 가장 결정적인 knock out과의 차이는 바로, 설계도를 건드려서 '불량 설계도'.... 정확히 는 '훼손된 설계도'를 만드는 것이 아니라, '정상설계도'가 '공장'으로 전달이 되는 것을 막아서 유전자를 off시킨다=발현을 막는다 라고 볼 수 있습니다.
위에 링크가 되었는 포스팅인 [단백질의 PTM(Post Translational Modification)]에 나와 있는 비유이지만, 일반적으로 DNA는 핵이라는 도서관 속에 있는 대출불가의 도서입니다. 그래서 복사기에 해당하는 '전사인자(transcription factor)'에 의해서 RNA라는 복사본이 생성이 되어서 도서관 밖으로 반출이 되고, '공장'에 해당을 하는 '라이보좀(ribosome)'에 가서 제품인 '단백질'을 만들게 됩니다.
여기서 '에피게놈 편집'은 바로 '복사기-전사인자'에 주목을 해서, 유전자의 발현을 끄고 켤 수 있게 된 것입니다. 위 그림의 묘사대로 유전자가 단백질로 발현=on이 되기 위해서는 핵이라는 도서관 밖으로 직접 DNA자체가 나갈 수 없기에 복사본인 RNA를 만들어서 내 보내게 되는 것 입니다.
그런데 이 DNA속에 있는 유전자를 복사한 복사본인 RNA를 만드는 데 '전사인자(transcription factor)'가 붙어서 RNA를 만드는 '전사(transcription)'과정에서는, 전사가 시작하는 부위가 있는데, 이를 '프로모터(promoter)'라고 합니다. 얼핏 간단하게 생각해서 이 promoter를 고장내면 될 것 같지만, 그렇게 안하고 아래와 같은 방법을 써서 유전자의 on/off를 조절할 수 있게 됩니다.
위 그림에서 DNA를 구성하는 염기중에 하나인 사이토신 혹은 시토신(cytosine)에 '메틸화(methylation)'이 일어나게 되면, 위 그림의 묘사와 같이 원래는 -극을 띄어서 +극을 띄는 단백질인 '전사인자(transcription factor)'와 잘 결합을 해야 하는데, promoter(프로모터)에 있는 사이토신이 모두 '메틸화(methylation)'이 되면, 이 프로모터는 단백질과 같은 +극을 띄어서 서로 제대로 붙어 있을 수가 없어지게 됩니다.
그래서 복사기에 해당한다고 볼수 있는 '전사인자'가 프로모터에 붙지를 못해서, 위에서 묘사를 했는 도서관에 비유를 하자면, 복사기가 고장이 나서 도서관에 있는 대출불가 도서를 복사해 갈 수 없는 것 입니다. 결국 설계도의 복사폰인 RNA를 가지고 오지 못했기 때문에 '공장'에 해당을 하는 '라이보좀(ribosome)'이 단백질을 만들 수 없다는 것을 선언하는 것 입니다.
그리고 이 에피게놈 편집은 의외로 크리스퍼/캐스나인 기술에 기반을 두고 있다고 볼 수도 있습니다. 먼저 위에서도 링크를 했는 [유전자를 절단하는 효과적인 가위-crispr/CAS9에한 이야기]에서 기존의 crispr-CAS9의 작동원리에 대해서 적어 놓았습니다만, 실제 에피게놈 편집은 크리스퍼/캐스나인에 비해서 몇 가지가 다릅니다.
우선 cripsr/CAS9에 사용이 되는 녹색의 단백질은 위그림에서 묘사가 된 CAS9이라는 DNA제한 효소로, 원래는 DNA를 잘라야 하는데, 에피게놈 편집에서는 'dCAS9' 이라고 해서 DNA를 절단하는 기능이 고장난 dCAS9을 '가이드 RNA'에 상보적인 DNA배결에 그냥 '붙기만'합니다.
그리고 여기서 사용이 되는 dCAS9,에는 'DNA메틸화 효소-에피게놈 효소'를 결합시켜서, dCAS9이 붙은 DNA서열 근처에 있는 [promoter를 메틸화] 시키게 됩니다. 이후는 앞서 설명한 것과 같이, +극성을 Promoter가 띄게 되므로써, 전사인자가 프로모터의 sequence에 붙지 못하게 되어서 더이상 RNA가 없다 = 더 이상 발현될 protein이 없다. 입니다.
이상으로 기존의 cripsr/CAS9을 응용해서 조금은 새로운 방식으로 유전자의 발현을 on/off-켜고 끄는 방식의 유전자 조작 방법법을 살펴 보았습니다. 물론 이 에피게놈 편집에도 crispr/CAS9이 불러온 논란과 가져다 줄 유익한 면, 둘 다 가능성이 있지만, 아직까지는 이게 만능의 도구는 아니라고 할까요? 여전히 인력이 팔요로 하는 곳은 있으리라 생각이 됩니다. 다만 특정 질병(특히 유전병)에 심각하게 관여하는 유전자의 켜고 끄기를 통해서 수 많은 치료법이 연구되고 있는 현재, 앞으로 정말 유망한 기술이 아닐까 합니다.
'생명과학 이야기' 카테고리의 다른 글
| 플라세보 효과에 대한 연구 (0) | 2019.11.24 |
|---|---|
| 사람의 성격을 결정할 수도 있는 미생물들? (0) | 2019.02.12 |
| 그렇게 까지 새롭지는 않은 바이러스 치료 요법 (0) | 2018.06.24 |
| 과거와는 다른 유전자 운반체 (0) | 2018.04.27 |
| 게놈 편집 치료하는 것이 있다고 합니다. (0) | 2018.04.25 |